第一类医疗器械是指风险程度低,实行常规管理可以保证其安全、有效的医疗器械。根据《医疗器械监督管理条例》的相关规定,对第一类医疗器械的监管实行备案管理。而“第一类医疗器械备案信息表”则是这一管理流程中的核心文件。
一、备案信息表的核心作用
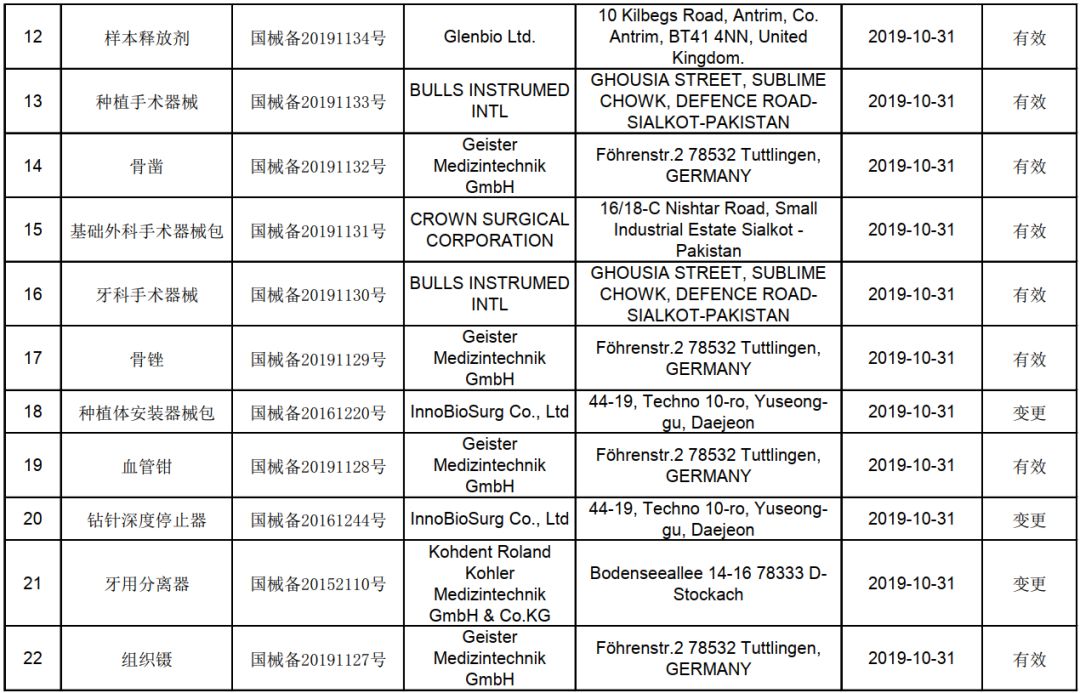
该信息表是境内第一类医疗器械备案人(通常为医疗器械生产企业)或进口第一类医疗器械的境外备案人,在向相应药品监督管理部门提交备案申请时所必须填写的正式表格。其主要作用是记录医疗器械的基本信息、分类信息、备案人信息、产品技术要求等,是监管部门对产品进行登记和后续监管的依据。
二、备案信息表的主要内容
一份完整的第一类医疗器械备案信息表通常包含以下关键信息:
- 备案人信息:包括备案人名称、住所、联系方式、统一社会信用代码等。对于进口产品,还需提供境外备案人及代理人的相关信息。
- 产品基本信息:包括产品名称、型号/规格、产品描述、预期用途、分类编码(根据医疗器械分类目录)等。
- 产品技术要求:简述产品应当符合的强制性国家标准、行业标准,或备案人自行制定的产品技术要求。
- 产品检验报告:声明产品检验合格,并承诺提交的备案资料真实、完整、可追溯。
- 临床评价资料:声明产品符合第一类医疗器械免于进行临床评价的相关规定。
- 生产制造信息:境内生产需提供生产企业信息;委托生产需提供受托企业信息及委托合同;进口产品需提供境外生产企业信息。
- 其他声明与签章:备案人承诺对备案资料的真实性负责,并由法定代表人或授权人签字,加盖公章。
三、备案流程简介
备案人需通过国家药品监督管理局指定的在线政务服务平台,在线填写并提交《第一类医疗器械备案信息表》及相关电子资料。资料符合要求的,药品监督管理部门将即时完成备案,并公布备案号及备案信息。备案人可自行下载打印备案凭证。
四、重要注意事项
- 真实性与合规性:备案人对备案资料的真实性、准确性、完整性、合法性和可追溯性负全部责任。备案信息发生变化时,应及时提交变更备案。
- 非注册审批:备案不等同于注册审批,不代表监管部门对产品安全有效性的“批准”,而是基于备案人的自我声明和承诺进行的存档备查。
- 动态监管:完成备案后,产品即可上市销售。但监管部门会通过监督检查、抽样检验等方式进行上市后监管,确保产品持续符合要求。
总而言之,《第一类医疗器械备案信息表》是第一类医疗器械上市前合规准入的关键一步。企业务必确保信息填报准确、完整,并理解备案管理的责任与义务,确保产品在整个生命周期内安全有效。